Nesta semana Jô Soares surpreendeu na TV. Em vez de começar seu tradicional programa de entrevistas com um tom humorístico, Jô deu uma aula sobre autismo. Seu filho autista, Rafael, com 50 anos, faleceu em decorrência de um tumor cerebral.
Se o tumor teve alguma relação com o autismo de Rafael não sabemos, mas é uma hipótese factível. Recentemente foi mostrado que cérebros de autistas contêm regiões com excesso de neurônios, o que, muito provavelmente, é causado por mutações em genes que regulam a divisão de células progenitoras neurais. Mas até o momento não existe nenhum estudo mostrando alta frequência de cânceres em indivíduos autistas. Nem consigo imaginar como era o mundo quando Rafael nasceu. Sabíamos muito pouco sobre autismo.
O estudo do autismo e outras doenças neurológicas é complicado porque não temos disponíveis para testes neurônios humanos de indivíduos afetados. Lógico que existem outros modelos, como o material post-mortem ou mesmo animais que simulam o comportamento autista. No entanto, nenhum desses modelos oferece as vantagens de um modelo experimental humano.
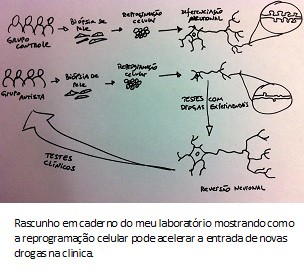
Em 2010, usamos uma nova estratégia para estudar o espectro autista, a reprogramação celular. Utilizando indivíduos com a síndrome de Rett como prova de princípio, reprogramamos células da pele em neurônios. Dessa forma, obtivemos neurônios vivos para estudos em laboratório pela primeira vez na história. Optamos por fazer isso com a síndrome de Rett porque entendemos a base genética: mutações num único gene, conhecido como MeCP2.
Descrevemos que neurônios derivados de indivíduos com síndrome de Rett eram menores e menos complexos que neurônios derivados de indivíduos não afetados. Além disso, neurônios Rett tinham dificuldade em estabelecer conexões nervosas ou sinapses. Talvez o mais impressionante foi mostrar que tratamentos com drogas experimentais foram capazes de reverter os defeitos desses neurônios, sugerindo que certas doenças do desenvolvimento neural poderiam ser tratadas ou mesmo curadas. Usando nossos métodos, outros pesquisadores reproduziram essa descoberta e também mostraram que a reversão era possível em outras formas sindrômicas de autismo, como a síndrome de Phelan-McDermid.
Na próxima semana, será publicado um novo trabalho de meu grupo, junto a colaboradores internacionais, mostrando que o que aprendemos com a síndrome de Rett também acontece com o autismo clássico (Molecular Psychiatry, 2014). Dessa vez, reprogramamos células da polpa de dente de leite de um indivíduo autista brasileiro. As células desse indivíduo fazem parte de um estudo que já estava em andamento por Maria Rita Passos-Bueno (Genoma/USP) desde 2008, financiado pelo Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) e Fundação de Amparo à Pesquisa do Estado de São Paulo (Fapesp). Quem liderou o artigo foi a brasileira Karina Griesi Oliveira, em parceria com um aluno americano, Allan Acab.
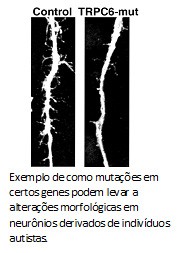
O que a Karina e o Allan mostraram foi que morfologia dos neurônios derivados desse autista mostrou-se menos complexa, com uma arborização menor do que o grupo controle. O número de sinapses e fisiologia das redes nervosas também estavam alteradas. Mas, ao contrário das formas sindrômicas do espectro, autistas clássicos possuem uma base genética complexa. Para entender o porquê dos defeitos nos neurônios desse paciente, decidimos sequenciar o genoma do paciente. Encontramos diversas mutações, inclusive uma que anulava uma das cópias do gene TRPC6. Esse gene codifica para um canal na membrana celular que permite a entrada de cálcio, um sinalizador para a formação de sinapses e maturação neuronal. Como o paciente possui apenas uma cópia funcional do gene TRPC6, isso explicaria a redução de sinapses e as alterações morfológicas observadas.
Mostramos que esse gene era realmente responsável pelos defeitos nos neurônios de duas formas. Primeiro, aumentamos a dose de TRPC6 nos neurônios do autista e eles passaram a se comportar como neurônios controle. Em seguida fizemos o oposto: reduzimos a atividade do TRPC6 em neurônios normais e estes se comportaram como se fossem autistas. Segundo, usamos uma droga chamada hiperforina, o princípio ativo da erva de São João (Hypericum perforatum), que estimula a entrada de cálcio pelo canal TRPC6. Curiosamente, o chá dessa erva é usado como um antidepressivo natural, ajudando casos de inquietação, ansiedade e nervosismo, principalmente na Europa. Ao expor os neurônios do autista a hiperforina por duas semanas, conseguimos reverter os falhas neuronais, aumentando o número de sinapses e recuperando as alterações morfológicas. É possível que o uso do extrato dessa planta ajude a melhorar os sintomas autistas em indivíduos com mutações nessa via metabólica. Até aonde sabemos, menos de 1% dos autistas carregam mutações nesse gene e se beneficiariam de um eventual tratamento.
Uma outra descoberta desse estudo foi que a atividade do gene TRPC6 é controlada pelo MeCP2 (o responsável pela síndrome de Rett). Isso mostra que diferentes tipos de autismos dividem vias moleculares semelhantes, algo muito útil do ponto de vista terapêutico. E para validar essa observação, testamos o efeito de IGF-1 (uma droga em teste clínico para síndrome de Rett) em neurônios do autista clássico. Como prevíamos, o IGF-1 também conseguiu reverter os defeitos nos neurônios do autista clássico, validando seu futuro uso clínico para autismo não-sindrômico.
Esse trabalho confirma a plasticidade dos neurônios humanos, capazes de se adaptar e reverter defeitos morfológicos e funcionais. É mais uma forte evidência de que o “estado autista” não é permanente, e pode ser reversível. Por muito tempo se acreditou que as síndromes genéticas do desenvolvimento seriam simplesmente incuráveis.
Abrimos precedente para a medicina personalizada para o espectro autista. Ao combinar a reprogramação celular com a genômica, conseguimos detectar vias metabólicas que estariam implicadas no quadro clínico, possibilitando receitar medicamentos e doses adequadas para cada individuo. Pode parecer ficção científica, mas não é. Num futuro próximo, cada autista terá seu genoma sequenciado e seu “minicérebro” em laboratório para estudo e testes de drogas.
Não sei o quanto o Jô Soares acompanha os avanços na pesquisa sobre o autismo, mas com certeza aprendemos muito nesses 50 anos. Compreendemos melhor as bases genéticas do autismo e sabemos que o determinismo genético não tem a última palavra. Desmistificamos as vacinas como causadoras do autismo e aprendemos mais sobre como outros fatores, como idade dos pais, podem contribuir para a frequência de autismo na população humana. Estamos vivenciando uma transformação conceitual que, em geral, precede movimentos revolucionários na medicina.
Nenhum comentário:
Postar um comentário